您当前的位置: 新闻资讯
- 2022-10-102022年10月5日,卫生委员会再次更新了欧盟COVID-19抗原检测的共同清单。本次更新的主要变化在于申请清单的流程,IVDEAR团队就 HSC Common List 最新版主要变化内容作如下梳理。
- 2022-10-0810月7日,雅培公司的实时PCR猴痘检测试剂盒Alinity m MPXV已获得FDA紧急使用授权。目前,雅培公司成为第二家获得FDA猴痘检测试剂盒紧急使用授权的企业。
- 2022-09-30日前,IVDEAR团队在总公司国瑞中安集团的指示下成立国瑞中瀚临床医学研究有限公司。国瑞中瀚坐落于广东省广州市白云区,致力于为各大企业提供更专业更高水准的临床试验研究解决方案服务。
- 2022-09-29为进一步规范定性检测体外诊断试剂分析性能评估等申报资料的管理,9月28日,国家药监局器审中心组织制定了六大指导原则,现予发布。
- 2022-09-139月7日,澳大利亚治疗用品管理局(TGA)批准了首个COVID-19 和流感自检组合试剂盒上市销售。开展甲型流感病毒、乙型流感病毒联合检测,用于临床对疑似患者的辅助诊断,早诊断、早隔离、早治疗,是提高流感治愈率、降低病死率的关键。
- 2022-09-099月7日,美国卫生与公众服务部 (HHS) 部长 Xavier Becerra 根据FD&C法第564条签署了一项重要声明。该声明批准体外诊断试剂检测和/或诊断猴痘病毒感染,包括检测和/或检测猴痘病毒感染的体外诊断试剂产品的紧急使用权(EUA)。
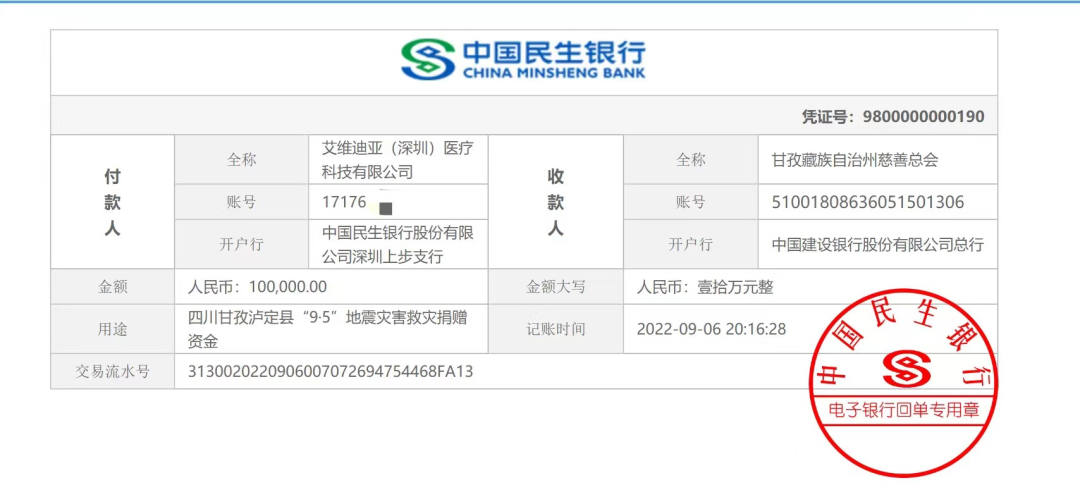
- 2022-09-06一方有难,八方支援,9月6日,IVDEAR团队通过甘孜藏族自治州慈善总会向灾区捐赠100000元人民币,支援灾后援助工作。
- 2022-08-22近日,圣湘生物自主研发的猴痘病毒核酸检测试剂盒(PCR-荧光探针法)通过英国MHRA认证,该产品获得英国MHRA注册后,可在英国和认可英国MHRA注册的国家或地区销售,这是继欧盟CE之后斩获的又一权威认证。
.png)
.jpg)