在体外诊断制造商产品设计阶段中,干扰物质会影响产品性能,使得产品产生不必要的差,但是实验室无法轻易检测到由干扰物引起的误差。为了避免这个问题,我们在试验设计方面可以参考哪些指南文件呢?
在干扰试验设计方面,我们可以参考EP07第三版指南,主要内容见图1:
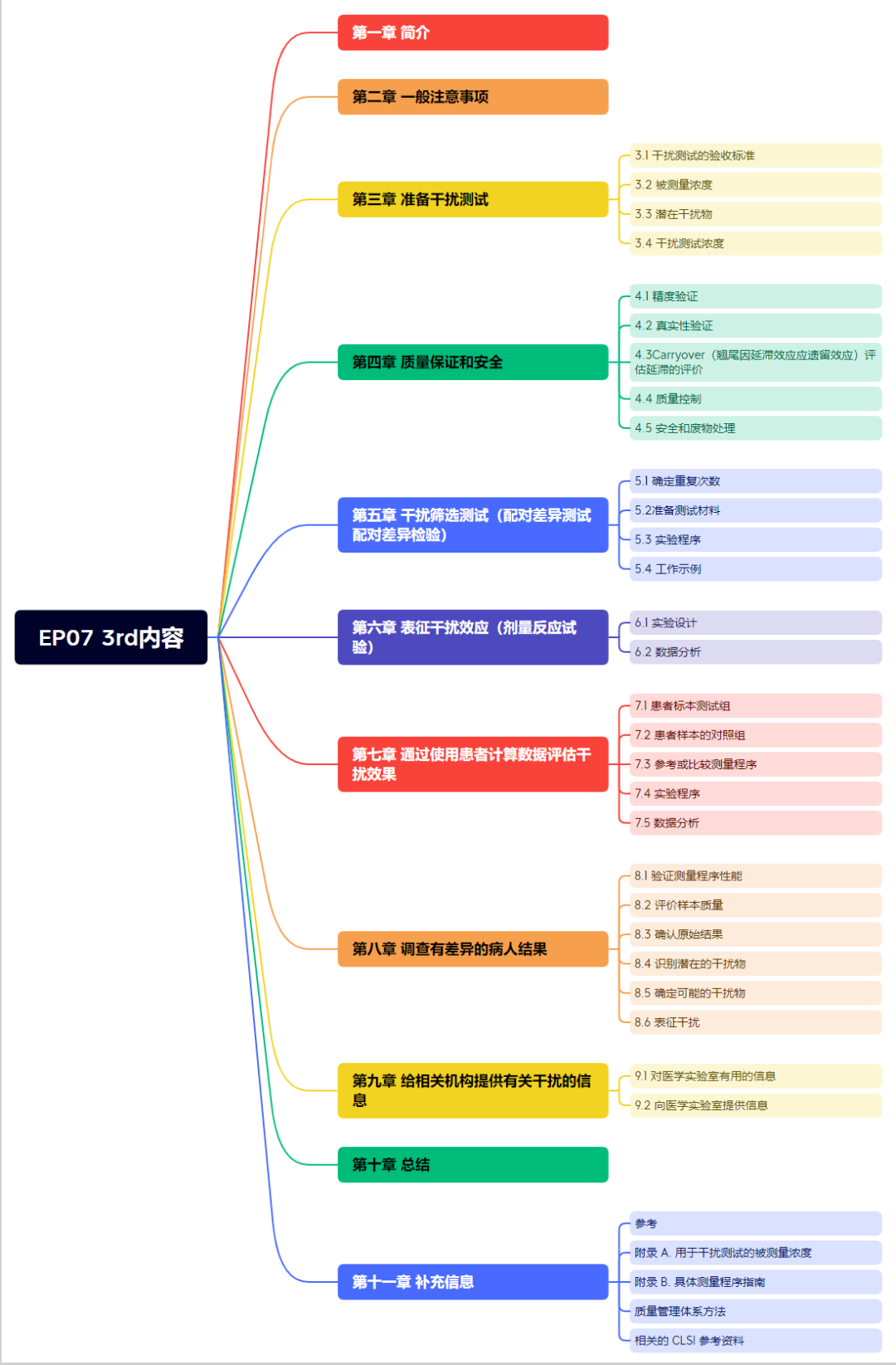
图1:EP07第三版内容框架
该指南可帮助制造商和实验室评估干扰物、确定干扰影响的程度、了解医疗需求的背景、并告知客户已知的医学重大错误的来源,以避免此类错误。本指南还确定了在风险管理过程中需要评估的许多潜在干扰物。
整体干扰测试试验流程图设计请见图2 。
.png)
图2:干扰测试流程图
那么在准备完所有可能干扰测试的物质和浓度后,如何进行干扰筛选测试呢?制造商标签中撰写的干扰物质是怎么选择出来的呢?我们需要使用什么方法和步骤来设计试验呢?
此时我们就可以参照EP07第三版中的第五章的干扰筛选测试章节。该测试大致框架请见图3。
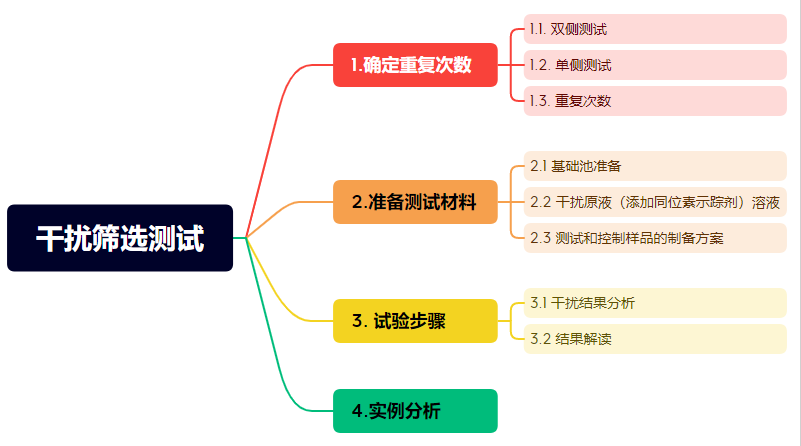
图3:干扰筛选测试框架
如何进行干扰筛选测试呢?首先要确定试验重复次数,其次要准备测试材料,之后要设计试验步骤并进行干扰结果分析和解读。
第一步:确定重复次数
在得出物质干扰或不干扰的结论之前,我们需要确定重复试验的次数,以便于有足够的功效来执行测试和检测具有医学意义的干扰,并有足够的置信度来识别何时不存在试验差异呢?
所需置信度和功效所需的重复次数取决于所检验的统计假设:
• 当备择假设未说明干扰的方向(正面或负面)时,使用双侧检验。例如,在肌酐测试中,当样品中存在浓度为14.4mg/dL 的阿米卡星干扰物时,观察到 ± 0.2 mg/dL 的差异,浓度为1.0 mg/dL 肌酐。
• 当备择假设中包含干扰方向(正或负)时,使用单侧检验。例如,在肌酐测试中,当样品中存在浓度为 14.4 mg/dL 的阿米卡星干扰物时,观察到+ 0.2 mg/dL 的差异,浓度为1.0 mg/dL 肌酐。
使用最少的重复次数,以确保研究具有适当的统计功效和所需的重复次数。当计算出的重复次数少于5次时,测试样品和对照样品至少应重复5次,当计算出的重复次数超过5次时,应测试较高样品的重复次数。
对于双侧测试,假设测量误差服从正态分布,并且测试样本和对照样本的重复性大致相等,则所需的重复次数可通过等式 (1)计算得出。
注:添加乘数2是为了考虑两个正态分布随机变量之间差异的 SD。

其中:
• z1−α/2是标准化正态分布的第 100(1−α/2) 个百分位数。
• z1−β 是标准化正态分布的第 100(1−β) 个百分位数。
• σ 是根据先验知识(例如制造商对精度的声明、精度研究的结果(参见CLSI文件EP1550)或其他一些其他知识)在相关对照样品浓度下测量程序的假设重复性(批内)SD 基础。
• δ是,由干扰物引起的,在待检测的被测量浓度的均值之间允许的差异。这是最大允许差异;任何大于此值的差异都被认为具有医学意义。
β值应设置为0.20或更小,α值应设置为0.05或更小,从而保证至少80%的功效和不超过5%的假阳性率。重复次数 (N) 需要为整数,因此 N 的计算值始终向上取整。
注:当使用20个重复时,5%的假阳性率平均允许不超过一个假阳性结果。
例如,评估者需要检测1.5mg/dL 的效应(或更高),已确定为可接受的干扰程度,置信度为95% (α=0.05) 和功效(power)为 95% (β=0.05)。这需要双方面的考验。重复性SD为1.0 mg/dL。
为了计算所需的重复次数,使用等式 (1):
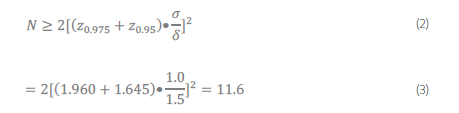
因为 N 需要是一个整数,所以数字总是四舍五入。因此,上例中每个样本(测试和控制)所需的重复次数为 12。
对于单测测试,将等式(1)中的 z1−α/2 替换为z1−α:
z1−α是标准化正态分布的第 100(1−α) 个百分位数,对应于错误拒绝单边检验的总体均值相等假设的 I 类错误的概率α。

为方便起见,表1中显示了一些常用置信度和功效水平的z值。
表 2 表示测试样本 (NT) 所需的最少重复次数和对照样本 (NC) 所需的最少重复次数。测试和控制样本的最终重复测试次数不必相同,但至少应满足每个样本的最小值。需要检测的重复次数
表 2 显示了具有 95% 置信度和 90% 功效的双侧测试的各种干扰效应。为方便起见,干扰标准表示为重复性(批内)SD (δ/σ) 的倍数。
.png)
在这些情况下,至少需要测试五次重复测试和五次重复控制。
以下例子说明了足够数量的重复的重要性:在 25 mIU/mL 时,假设测定的重复性 CV 为 5%。通过充分的复制,可以减少不精确的影响,从而可以检测到 7% 的可能干扰。要使用 95% (α = 0.05) 的置信度和 90% (β = 0.10) 的功效来确定检测 7% 干扰所需的重复次数,商 (δ / σ) 表示为倍数 重复性,无论是在 SD 上的差异还是在 % CV上的百分比差异(例如,7%/5%=1.4)。
然后,使用5.1.3小节中的表2来确定所需的重复次数,在本例中为11。当较大量的干扰被认为是可以接受的时,例如10% (δ/σ=2) 的影响,则需要较少的重复。表2显示,在允许干扰较大的情况下,控制和测试条件只需要6次重复,而不是11次。
第二步:准备测试资料
在设计干扰筛选测试时如何准备测试材料呢?我们需要准备基础池和干扰原液(添加同位素示踪剂)溶液。
按如下方式准备基础池: | |
1 | 计算所需的样本量,考虑测量程序的样本量、待测潜在干扰物的数量以及所需的重复次数。 |
2 | 从几个未服用药物或其他补充剂的健康个体中获取无黄疸、无混浊和无溶血的适当标本(例如,全血、血清、血浆、尿液)。 基础池应尽可能反映通常用于被测量的样本矩阵。首选样本来自个体捐献者,在符合被评估的测量程序使用说明的条件下收集、运输和储存样本。 必要时,可以验证存储时间超过使用说明中的时间是可以接受的。 |
3 | 通过组合单个样本或多个样本,在保持基础池完整性的条件下搅拌均匀。 |
4 | 测定基础池中被测物的浓度。避免将其他物质与被测物一起引入。 |
5 | 将基础池分成单独的子池(基础池的等分试样)。 通过添加分析物并补偿可能存在的任何内源性量,将每个单独子池中的被测量浓度调整到所需的被测量浓度。 |
注 1:当同时添加被测量和干扰物时,可能会引入基质效应变化。 注 2:当无法添加分析物(例如抗体)时,以待测被测量浓度从真实的患者样品中制备每个样品池是可以接受的。 | |
干扰原液(添加同位素示踪剂)溶液制备 | |
1 | 获得潜在干扰物的适当纯度形式,或最接近体内循环形式的形式。 使用药物级制剂时,请记住它们可能含有赋形剂、防腐剂、杀菌剂、杀真菌剂、抗氧化剂、着色剂、调味剂、金属氧化物、抗衡离子和填充剂,其中任何一种都可能是观察到干扰的效果的真正原因。 |
2 | 选择一种溶剂,其中潜在的干扰物足以易溶。 检查适当的参考资料 53、54 了解溶解度这些溶剂中的潜在干扰物。 验证溶剂不会对正在评估的测量程序造成干扰。按一般优先顺序列出的一些可能的溶剂是: • 试剂级水(Reagent-grade water)(详见CLSI 文件 GP4055信息) • 水性缓冲液 • 稀释的 HCl 或 NaOH • 乙醇或甲醇 • 丙酮 • 二甲基亚砜 • 其他有机溶剂 有机溶剂需要特别考虑。 应防止挥发性溶剂蒸发。许多有机溶剂在水中的溶解度非常低,或者会通过影响样品、试剂或反应本身而引入人为因素。由于溶解度低,氯仿至少需要在血清中稀释 1:100。 注意:高浓度的溶剂可能会导致蛋白质沉淀。 |
3 | 在溶解度允许的情况下,尽可能少地稀释样品基质,最好不超过 5%。方法是制备至少为预期测试浓度 20 倍的浓缩储备液。 |
4 | 彻底记录储备溶液的制备。 |
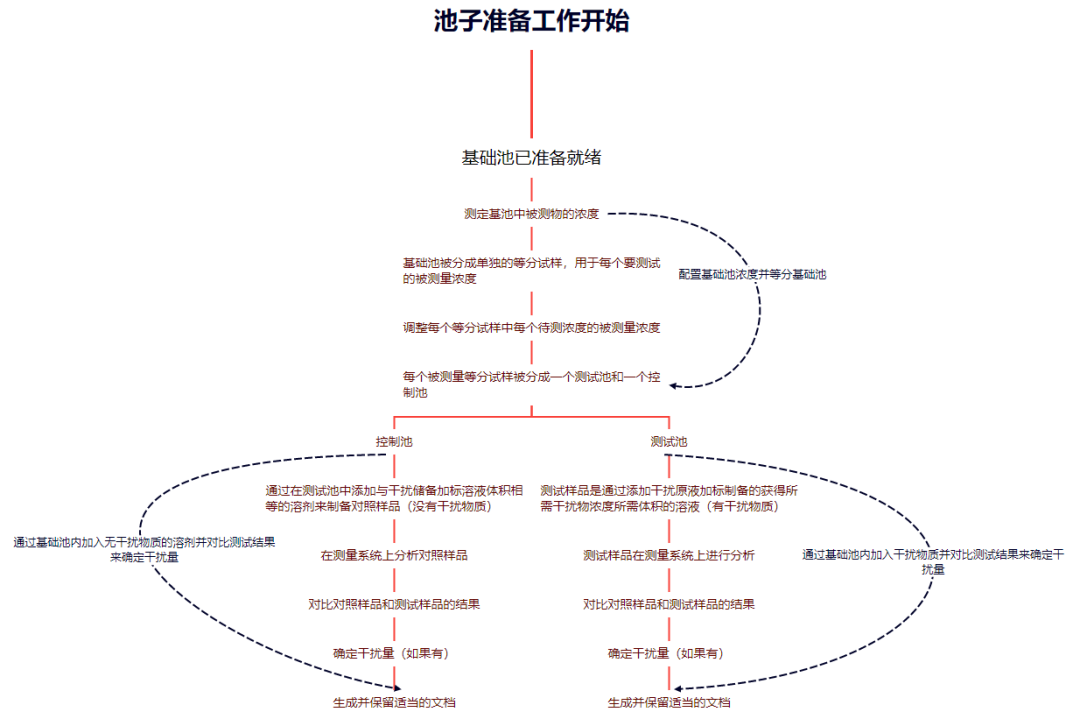
图4:测试和控制样品的制备方案
测试样品:测试样品是通过将干扰储备加标溶液添加到每个待测被测浓度的基础池的等分试样中制备的,如图4所示。
对照样品:对照样品的制备方法是将与储备加标溶液(不含干扰物)相同的溶剂添加到与用于制备测试样品的干扰储备加标溶液等量的基础池等分试样中,如中所示图4。
第三步:确定试验步骤
在准备好测试材料后,如何确定试验步骤呢?
实验步骤(配对差异干扰测试) | |
1 | 确定合适的待测被测浓度(见附录 A)。 |
2 | 建立允许差异 (δ) 的标准。 |
3 | 确定每个样本所需的重复次数 (N)。 |
4 | 从患者标本中制备一个基础池。 将基础池分成等分试样,用于每个要测试的被测量浓度。并根据需要调整每个等分试样中的被测量浓度,同时考虑可能存在的任何内源性干扰物质被测量。 |
5 | 准备浓度为待测潜在干扰物浓度 20 倍的干扰物加标储备液。这是干扰储备加标溶液。 |
6 | 将储备加料溶液和基础池样本按一份储备加料溶液的比例混合成 19 份基础池样本(1 比 20 稀释),充分混合,这是测试 (T) 样本。 示例:将 9.5 mL 基础池添加到 10 mL 容量瓶中。添加 0.5 mL 的 20× 库存加标溶液以达到 10.0 mL 的总体积。 |
7 | 将用于制备储备加料溶液的相同溶剂与基础池样本混合到第二个烧瓶中,比例为一份溶剂与 19 份基础池样本(1 比 20 稀释),并搅拌均匀。这是控制(C)样本。 示例:将 0.5 mL 溶剂添加到 10 mL 容量瓶中。添加基础池样本达到 10.0 mL 的总体积(添加 9.5 mL基础池)。 |
8 | 在测量系统上重复测试 N 个测试和控制样本。重复次数 N 在步骤 3 中确定。如果适用,测试和控制样本的分析方式与患者标本相同,在一次分析运行中进行。 注 1:当测量程序存在残留时,请仔细设置用于测试的样品序列。 注 2:准备测试和对照样品与实际测量它们之间的时间段可能因分析物或干扰物的稳定性、是否需要达到稳定状态等而异。提醒读者了解分析物- 干扰相互作用并相应地进行。 |
9 | 记录数据分析结果。 |
注:当使用不同的库存溶液浓度时,相应地调整步骤 6 和 7 中的稀释度。 | |
3.1 干扰结果分析
在拿到试验结果后,如何进行干扰结果分析呢?
干扰的幅度是主要的测量目标。 这应尽可能确定为存在和不存在干扰物时测量系统响应的平均差异(测试样品的平均测试结果的差异减去对照样品的平均结果)。
干扰效应的“点估计”dobs 计算为测试 (T) 和对照 (C) 样本的平均被测量值之间的差异,其中XT表示测试样本的平均被测量值,XC 表示对照样品的平均被测量值:
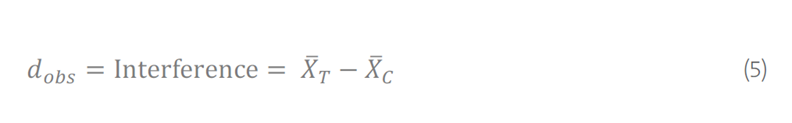
要计算干扰百分比 (% dobs),将观察到的干扰 (dobs) 除以对照样品的平均测量值 (C),然后乘以 100:
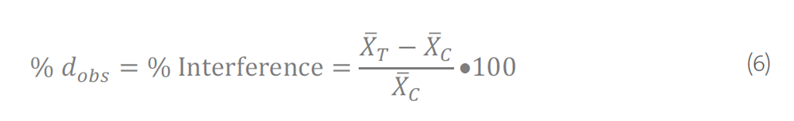
或者,可以根据等式 (7) 计算围绕差值的双侧 100(1 − α)% 置信区间。置信区间不是必需的,但在监管审查中可能会要求提供,这有助于理解观察到的干扰的可变性。
此外,置信区间可用于进行统计等效性检验,并得出结论认为给定的统计确定性没有医学上的显着干扰。
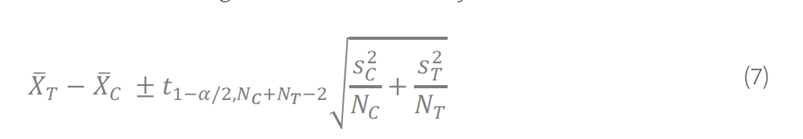
其中:
t1−α/2,NC + NT − 2 在学生 t 表中作为具有 NC + NT − 2 自由度的 t 分布的第 100(1 − α) 个百分位数被找到
• NC 是控制样品(C)的重复次数。
• NT 测试样本(T)的重复次数。
• SC 是根据NC 值计算出的对照样本的SD。
• ST 是根据 NT 值计算的测试样本的 SD。
注:
等式(7)假设测试和控制样本的方差不一定相同。
要计算相应干扰百分比周围的置信区间,请将根据等式 (7) 计算的置信区间的下限和上限除以控制样本 (C) 的平均被测量值,然后乘以 100,如下面的等式 (8) 所示 )。
.png)
如何解读试验结果呢?
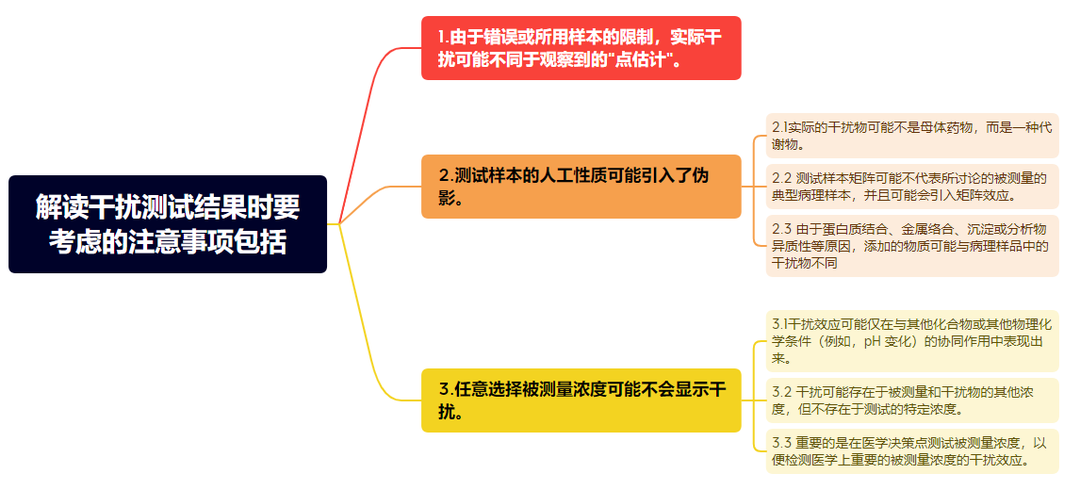
图5:解读干扰测试结果时要考虑的注意事项
在解读干扰测试记过时候要考虑以下注意事项:
1.由于错误或所用样本的限制,实际干扰可能不同于观察到的“点估计”;
2.测试样本的人工性质可能引入了伪影;
3.任意选择被测量浓度可能不会显示干扰。
在表3中,两种浓度的被测量(0.50mg/dL 和5.00mg/dL) 在存在最大干扰物的浓度 (500mg/dL)。测试了一组成对的测试(有干扰)和对照(无干扰)样品。测试和控制结果之间的差异以实际浓度单位和百分比差异计算。
注:两个级别的被测量浓度和最大值。
干扰浓度(即“最坏情况”情况)可能存在于患者样本中,适合筛查。 因此,在表3的示例中,建议在0.50mg/dL和5.00mg/dL的被测量水平下筛选最大干扰物浓度 500mg/dL。
%20%E6%A0%87%E5%87%86.png)
制造商使用的允许差异 (δ) 标准
在低被测量浓度 (0.50 mg/dL) 时为 ± 0.10 mg/dL,在高被测量浓度 (5.00 mg/dL) 时允许差值 (δ) 为 ± 10%。此示例表明在较低的被测量浓度下观察到干扰仅是因为观察到的 −0.20 mg/dL 差异超出了 ± 0.10 mg/dL 的允许差异,而观察到的 −9.0% 差异在允许差异范围内允许偏差±10%。请注意,高样本的 95% 置信区间上限超出了 ± 10% 的允许差异;然而,如第 5.3.2 节所述,因为-9.0%的点估计值在允许差值范围内,所以推断干扰物引起的差值在最大允许差值范围内。
注意:干扰不应总是仅基于百分比,适用于所有被测量浓度的差异。 对于某些被测量,通过考虑单位(例如,浓度、活性)的实际差异来确定干扰更合适,特别是在被测量浓度低时,当值的微小差异可能是很大的百分比差异。
.png)
国瑞中安集团-IVDEAR团队可承接欧盟、美国、澳大利亚、加拿大、英国等多国医疗器械及IVD器械注册咨询、辅导、技术文件编写、当地授权代表、临床性能评价、以及美国和欧盟、印度、非洲等地的临床试验研究项目,可为医械及IVD企业提供多国注册的全流程的解决方案服务。有相关项目需求的企业请联络IVDEAR团队。
.png)
.jpg)


